今天介绍一项中山大学附属纪念医院发表在《Cancer Cell》上的研究:Cancer cell-derived arginine fuels polyamine biosynthesis in tumor-associated macrophages to promote immune evasion,即:癌细胞来源的精氨酸通过促进肿瘤相关巨噬细胞中多胺合成来促进免疫逃逸。
研究首先发现乳腺癌患者血清中精氨酸水平与肿瘤分期的正相关,然后通过临床样本分析、单细胞RNA测序、小鼠模型实验发现精氨酸能显著促进乳腺癌的生长,且这种效应依赖于免疫细胞的存在,进而进一步发现和验证了精氨酸通过促进TAMs的促肿瘤极化来抑制CD8+ T细胞的抗肿瘤活性,最后揭示了精氨酸-多胺-TDG轴在癌细胞与巨噬细胞之间的代谢互作机制。
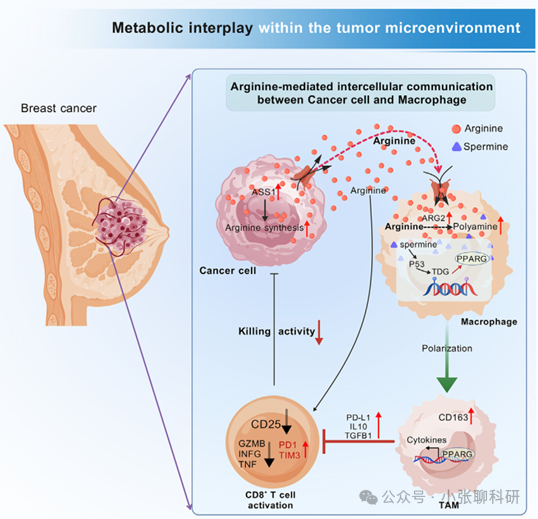
从临床现象出发:精氨酸与乳腺癌进展的关联
通过对608例乳腺癌患者的临床分析,研究团队发现血清中精氨酸水平与TNM分期呈正相关,且在晚期乳腺癌患者中精氨酸水平显著升高,进而发现精氨酸合成的关键酶ASS1主要表达在癌细胞中,这意味着癌细胞可能是TME中精氨酸的主要来源。
探索精氨酸的作用机制:免疫细胞的参与
研究团队在免疫健全的BALB/c小鼠中进行实验,发现外源性精氨酸能显著促进4T1乳腺癌的生长,而敲低癌细胞中的Ass1则抑制肿瘤生长,但在免疫缺陷的裸鼠中这种效应消失。这表明免疫细胞在精氨酸介导的肿瘤生长中起关键作用。通过单细胞RNA测序分析不同细胞类型间的精氨酸代谢通信,研究团队发现癌细胞与巨噬细胞之间的代谢互作在人类和小鼠乳腺癌中均占主导地位。鉴于巨噬细胞在肿瘤免疫中的重要作用,研究团队进一步聚焦于肿瘤相关巨噬细胞(TAMs)。
发现关键互作:精氨酸驱动TAMs的促肿瘤极化
研究团队发现精氨酸处理能剂量依赖性地增加巨噬细胞中促肿瘤细胞因子的表达,而精氨酸剥夺则抑制其表达。单细胞RNA测序也显示,高精氨酸代谢评分的巨噬细胞表达更多M2相关基因,而低评分的则表达更多M1相关基因。此外,M2型TAMs标志物CD163在晚期乳腺癌中上调且与血清精氨酸水平正相关,提示精氨酸可能通过促进TAMs的促肿瘤极化来推动乳腺癌进展。
深入探究:精氨酸如何影响TAMs
为了探究癌细胞分泌的精氨酸如何影响TAMs,研究团队利用癌细胞条件培养基诱导TAMs极化,并进行代谢组学分析,发现TAMs中精氨酸水平降低而鸟氨酸水平升高,表明精氨酸被转化为多胺。通过同位素示踪实验,研究团队证实巨噬细胞不能从头合成精氨酸,而是依赖癌细胞分泌的精氨酸。进一步实验表明,精氨酸代谢产生的多胺,尤其是精胺,通过p53/TDG介导的DNA去甲基化显著增强TAMs的促肿瘤极化。这一发现揭示了精氨酸-多胺-TDG轴在癌细胞与巨噬细胞之间的代谢互作中起关键作用。
验证巨噬细胞的关键作用
为了进一步验证巨噬细胞在精氨酸代谢中的关键作用,研究团队利用了NOG小鼠模型,通过PBMCs重建人源免疫系统。结果显示,只有在PBMCs存在的情况下,ASS1敲低才能抑制肿瘤生长,且这种抑制作用依赖于巨噬细胞的存在。此外,研究团队还通过小鼠乳腺癌模型(4T1和EO771)进一步验证了ASS1高表达和低表达组的T细胞发育轨迹,发现ASS1高表达组中耗竭性CD8+ T细胞显著富集。
验证与拓展:靶向干预的潜力
基于上述发现,研究团队在免疫人源化小鼠模型中验证了靶向TDG的治疗潜力。结果表明,TDG敲低显著抑制肿瘤生长,并减少TAMs浸润,同时增加CD8+ T细胞浸润。此外,通过抑制多胺合成也能达到类似效果。
课题和文章思路请联系Alice@解颐生物,扫码备注:科研合作