本文介绍了一种新型抗血栓涂层的研究,该涂层通过优化与凝血因子XII的相互作用来减少血栓形成。研究团队通过开发SPI涂层,实现了在不影响正常止血的情况下抑制血栓形成。该涂层具有血液相容性,并广泛应用于血液接触设备。文章详细阐述了SPI涂层的设计原理、实验过程和结果,以及与传统抗凝材料的区别。最后,文章提出了表面与FXII相互作用的新理念,为新一代抗血栓材料的设计提供了新方向。
当人工材料与血液接触时,通常会触发凝血反应,形成血栓,因此需要配合抗凝剂使用,但这增加了出血风险。目前已有多种防止表面引发血栓的方法,但效果不一,防污表面虽可减少凝血风险,但并不能完全避免蛋白质吸附,仍可能引发凝血。
为了真正设计出有效的抗血栓表面,需要进一步研究和改进策略。
赵伟锋教授团队联合其他研究人员开发了一种新型抗血栓涂层,该涂层带有屏蔽的正电荷,不依赖于特定的基材,并在实验中表现出出色的抗血栓效果。与传统通过排斥蛋白质来防止凝血的设计策略不同,这种涂层通过减少因子XII的激活来避免触发凝血反应。
新型抗血栓涂层称为SPI涂层,基于表面共轭的生物相容性正电荷大分子实现对蛋白质相互作用的选择性控制。SPI涂层可应用于各种生物医学表面,表现出优良的耐用性、亲水性和微弱的负电荷。实验结果表明,SPI涂层在接触激活方面显著低于未涂层表面,其他对照涂层如PDA/PEG和HPG/PEG仍然保持较高的接触激活。SPI涂层有效抑制了缓激肽和凝血酶的生成,并延长了血浆的凝固时间。在不影响正常止血的情况下,SPI涂层显著延缓了玻璃表面的凝血时间。
本研究提出了一种新型抗血栓表面设计理念,通过改变FXII与表面的结合特性,减少表面诱导的血栓形成而不干扰正常止血。该方法为血液接触装置提供了通用抗血栓表面,并加深了我们对表面蛋白质相互作用的理解,启发了新一代设计策略。

血液中含有多种蛋白质和细胞,形成一个通过调节因子在抗凝和凝血之间保持平衡的系统,以确保血液正常流动。然而,当人工材料与血液接触时,通常会触发凝血反应,开始形成血栓,因此需要配合抗凝剂使用,但这增加了出血风险。目前已有多种防止表面引发血栓的方法,但效果不一,防污表面虽可减少凝血风险,但并不能完全避免蛋白质吸附,仍可能引发凝血。要真正设计出有效的抗血栓表面,还需进一步研究和改进策略。
在这里,四川大学赵伟锋教授、赵长生教授联合加拿大不列颠哥伦比亚大学Jayachandran N. Kizhakkedathu教授团队通过开发了一种新的抗血栓涂层,这种涂层通过优化与凝血因子XII的相互作用而不是阻止其吸附,来减少血栓形成。该涂层带有屏蔽的正电荷,不依赖于特定的基材,并在实验中表现出出色的抗血栓效果——无论是在体外人血实验还是在兔颈动脉-颈静脉分流模型中,均能显著降低血栓风险。与传统通过排斥蛋白质来防止凝血的设计策略不同,这种涂层通过减少因子XII的激活来避免触发凝血反应。总体而言,这一涂层可以广泛应用于血液接触设备,并为未来抗血栓材料的设计提供了新方向。相关成果以“Antithrombotic coating with sheltered positive charges prevents contact activation by controlling factor XII–biointerface binding”为题发表在《Nature Materials》上,第一作者为Haifeng Ji。

赵伟锋教授

新型抗血栓涂层的概念、设计与合成
作者的研究通过检查不同表面特性(包括带负电的玻璃和钛、带正电的聚三聚氰胺和聚乙烯亚胺涂层的聚苯乙烯(PS)、疏水性PS、金属表面(钛和金)、以及中性亲水性PEG修饰的金表面(图1a,b))对凝固激活的影响开始。测试中发现,绝大多数表面缩短了血浆凝固时间,唯独带正电的表面几乎不影响凝固,这启示了开发阳离子抗血栓表面的可能性。然而,传统阳离子表面在血液中有毒,因其强静电结合引发不良反应。作者受此启发,设计了一种新型涂层,称为选择性蛋白质相互作用(SPI)涂层,基于表面共轭的生物相容性正电荷大分子(SPCM)实现对蛋白质相互作用的选择性控制。SPI涂层使用了聚多巴胺(PDA)和PEG的组合涂层结构,可适用于各种生物医学表面(图1d)。SPI涂层在稳定性测试中表现出优良的耐用性,并展现了亲水性(~10°水接触角)及微弱负电荷(-7 mV)。其颗粒状的表面形态和宏观结构如图1e所示。
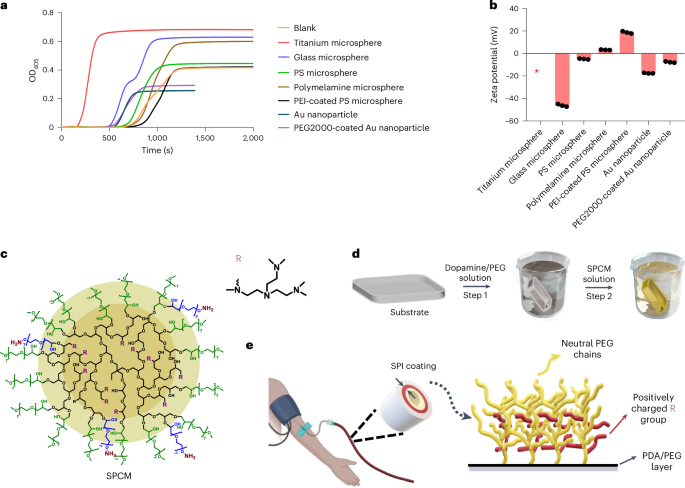
图1:SPI涂层的概念和合成
SPI 涂层可抵抗表面诱导的血栓形成
由于大多数表面通过接触途径激活凝血,作者研究了SPI涂层在此方面的效果。SPI涂层应用于多种常用于生物医学设备的表面材料,并在等离子体中孵育后,通过显色底物S-2302检测其对FXIIa和激肽释放酶的抑制作用。结果显示,SPI涂层在接触激活方面显著低于未涂层表面,而其他对照涂层如PDA/PEG和HPG/PEG仍然保持较高的接触激活(图2a)。此外,SPI涂层有效抑制了缓激肽(BK)和凝血酶的生成(图2b、2c),并延长了血浆的凝固时间(图2f)。在再钙化血浆中测试中,SPI涂层显著延缓了玻璃表面的凝血时间,从10分钟延长至1小时以上(图2g、2h)。同时,SPI涂层不会干扰血浆的正常止血功能,在引入肌动蛋白触发后凝血无延迟(图2i)。与肝素涂层和防污表面相比,SPI涂层展现出卓越的抗血栓性能,并在长期储存及吸附其他血浆蛋白后依旧保持有效(图2j)。这些结果初步证明了SPI涂层的抗血栓潜力。
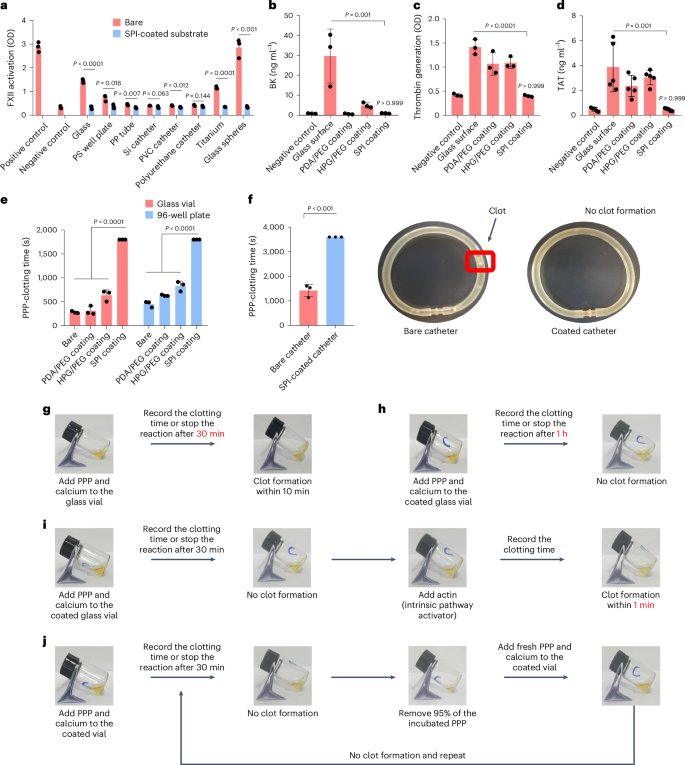
图 2:SPI 涂层可防止表面诱导的接触激活和血栓形成
SPI 涂层具有血液相容性
传统的抗凝材料或治疗可能中断正常止血并带来出血风险,而SPI涂层则不影响正常凝血过程。实验结果表明,SPI涂层与血浆孵育30分钟后,凝血酶原时间、活化部分凝血活酶时间、凝血酶时间和纤维蛋白原浓度均保持正常(图3a)。SPI涂层未激活凝血因子VII (FVII),从而避免了凝血系统的下游激活。蛋白质组学分析也显示,与SPI涂层一起孵育的血浆中凝血蛋白浓度无显著变化(图3b)。在与SPI涂层玻璃孵育的再钙化血浆中,PT和TT值未变,而aPTT值轻微延长,可能是因暴露于空气中导致的轻微接触激活。相比之下,裸露玻璃显著延长了凝血时间(图3d)。SPI涂层也避免了凝血因子大量消耗仅略微降低了其活性(图3e)。此外,SPI涂层能抑制血小板和中性粒细胞的粘附及活化,显示出良好的细胞相容性和低补体激活。这些结果表明,SPI涂层在不影响正常凝血的情况下具有出色的抗血栓潜力。
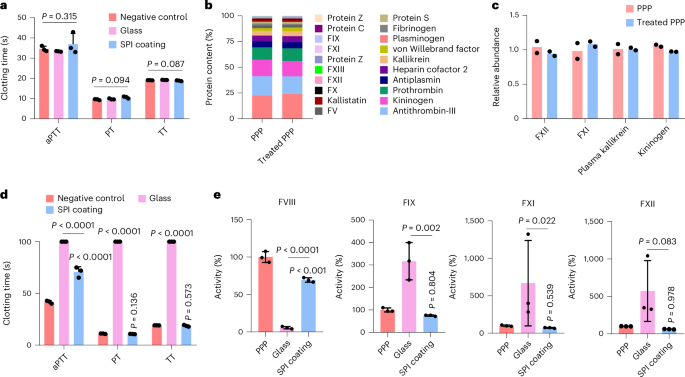
图 3:SPI 涂层可防止凝血酶生成而不干扰止血
SPI 涂层在动静脉分流模型中具有抗血栓作用
作者通过兔子动静脉 (AV) 分流模型测试了SPI涂层的抗血栓性能,以评估在无抗凝剂情况下导管内的血栓形成(图4a)。实验中,血流通过连接到PVC导管的留置针从颈动脉流向颈静脉,导管可选择使用SPI涂层处理。实验运行30分钟,期间动物的凝血参数(aPTT、PT、TT)和血液学指标保持稳定(图4b)。实验显示,未涂层导管在30分钟后产生严重血栓,导致血流几乎停止和导管堵塞(图4c、d、e)。相比之下,SPI涂层导管显著减少了血栓形成,保持通畅,血流速稳定(图4d、e)。此外,裸导管采集的血液显示凝固时间显著缩短,而SPI涂层导管的血液凝固时间无变化(图4f)。这些结果表明,SPI涂层有效抑制了导管表面的血栓激活。数字和扫描电镜图像显示SPI涂层导管上的血栓粘附显著减少,但在连接动脉的细针部分观察到一些凝块(图4h),这可能是血流经过狭窄针头导致的局部血流动力学变化所致(图4i,补充图31),引发了局部凝血。SPI涂层虽有效抗血栓,但对非自诱导的凝血激活因素无抑制作用。
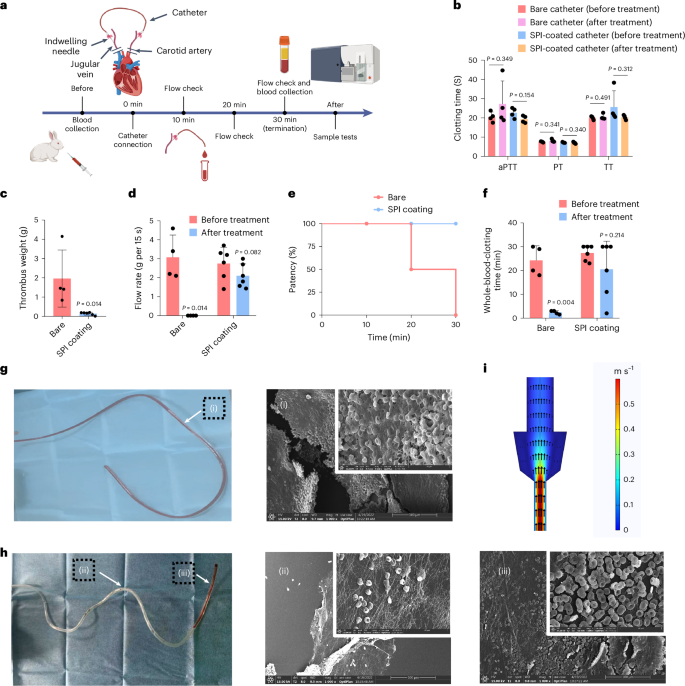
图 4:SPI 涂层在 AV 分流模型中具有抗血栓作用
SPI 涂层与 FXII 强烈相互作用,无需激活
尽管SPI涂层显著减少了接触激活和血栓形成,其机制仍不完全清楚。作者通过分析SPI涂层上吸附的蛋白电晕,研究了表面吸附蛋白的作用及其抗血栓功能。吸附蛋白可松散或紧密结合,影响表面功能。实验中设计了不同洗涤步骤,分析了玻璃和SPI涂层表面上的蛋白组成。温和清洗后,发现玻璃表面吸附了更多凝血蛋白,而SPI涂层吸附了更多FXII,且较少吸附FXI、前激肽释放酶和激肽原(图5a、5b)。彻底清洗区分出松散和紧密结合的蛋白,结果显示SPI涂层表面与FXII的相互作用更强(图5c、)。流式细胞术检测证实SPI涂层吸附更多FXII,与蛋白质组学分析一致(图5d)。总体而言,SPI涂层与FXII强烈相互作用,但这种相互作用并非启动表面诱导凝血的充分条件。
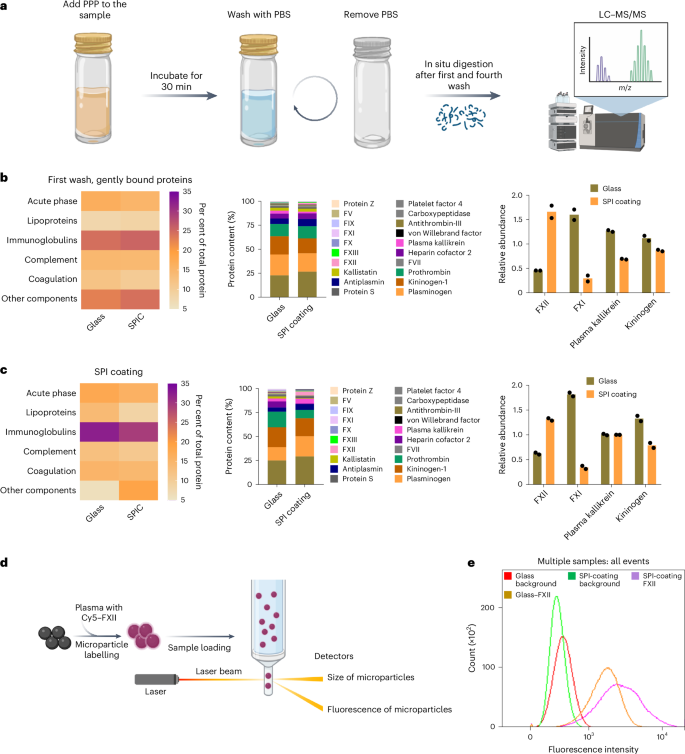
图 5:FXII 与 SPI 涂层表面牢固结合
SPI 涂层调节接触激活的机制
本研究表明,表面与FXII的强相互作用并非激活凝血接触途径的必要条件。通过比较不同表面对接触活化的影响,作者发现SPI涂层显著抑制血栓形成。实验显示,玻璃和HPG/PEG涂层的催化活性分别比SPI涂层高出30倍和4倍(图6a),这与其血栓形成倾向一致。进一步测试表明,SPI涂层未引起FXII和PK的水解,也未增强它们的相互激活(图6c)。此外,与其他表面不同,SPI涂层未导致FXII的显著活性变化(图6d),表明其抑制效果并非源自FXII、PK或KK的改变。流式细胞术显示SPI涂层解离的FXII虽有结构变化,但不增强其活性(图6f)。总结而言,SPI涂层虽引发FXII构象变化,但不会启动接触激活,从而减少血栓形成并实现正常止血效果(图6g)。
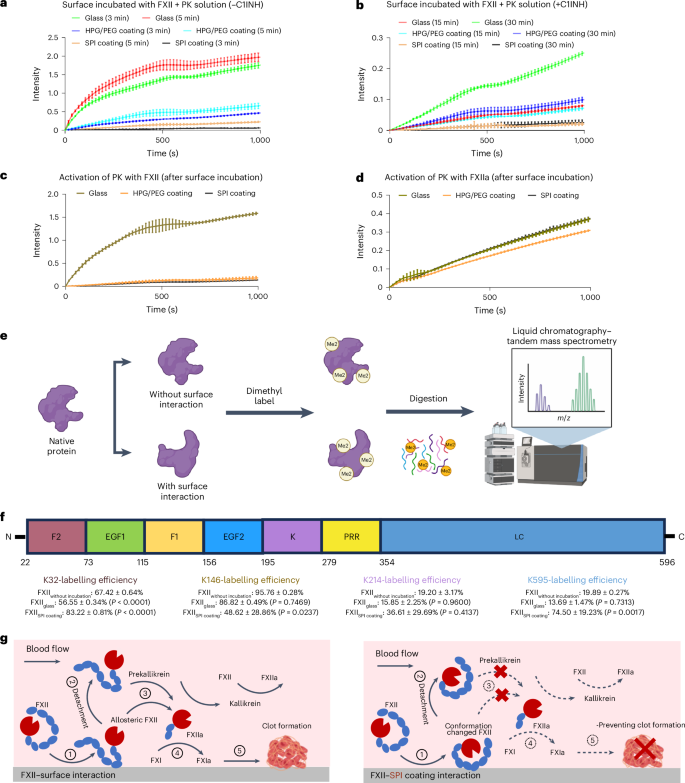
图 6:SPI 涂层的接触激活调节机制
小结
本文提出了一种新型抗血栓表面设计理念,通过改变FXII与表面的结合特性,使其既具备良好的血液相容性,又能减少表面诱导的血栓形成而不干扰正常止血。SPI涂层通过保护性的正电荷表面抑制了FXII-PK的相互激活。与传统抗蛋白质或防污表面不同,作者提出了另一种途径——利用强相互作用但不启动凝血的蛋白质结合SPI涂层。该设计在体外人血和无需抗凝剂的兔分流模型中都有效预防了表面诱导的血栓形成。此方法不仅为血液接触装置提供了通用抗血栓表面,还加深了我们对表面蛋白质相互作用的理解,启发了新一代设计策略。
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!


