
细胞死亡一直是国自然研究的热点,并且有各种不同诱因、不同通路导致的死亡方式:细胞凋亡、铁死亡、细胞焦亡、坏死性凋亡、失巢凋亡……等等,而大家也习惯通过某种细胞死亡方式的变化作为一些疾病病理现象的机制,比如:
某个因素(比如感染)导致细胞(肺泡上皮细胞)发生死亡方式A(比如细胞焦亡)比例增加,进而导致组织炎症和损伤;而药物P通过抑制细胞(肺泡上皮细胞)发生死亡方式A(比如细胞焦亡),抑制组织炎症和损伤,发挥改善疾病的作用。
这个看起来没有什么大问题的科学假说或者研究框架,在一些专家眼里是有一个大问题的,而且问题大到本子被直接毙掉。
这个问题是:不同细胞死亡方式的转换。
简单来说:细胞死亡方式之间是会发生转换的,如果A死亡方式被抑制的同时,转换成了B死亡方式,从总的结果来看细胞死亡比例未必降低,反倒有可能继续升高。
常见评语:
虽然细胞死亡方式A被抑制,但是没有排除细胞死亡方式B是否被激活的可能性,而死亡方式A-B之间是可以转化的,所以研究不够严谨。
而细胞死亡方式转换又是很多研究的主题,我们举两个例子说明:
1.PD-L1-mediated
gasdermin C expression switches apoptosis to pyroptosis in cancer cells and
facilitates tumour necrosis.Nat Cell
Biol. 2020 Oct;22(10):1264-1275.
PD-L1介导的Gasdermin C表达改变,将癌细胞的凋亡转变为焦亡,并促进肿瘤坏死。

焦亡对于巨噬细胞抵抗病原体感染至关重要,但其在癌细胞中的作用和机制尚不清楚。PD-L1已在细胞核中被检测到,但其功能未知。在这里我们发现PD-L1将TNFα诱导的癌细胞凋亡转变为焦亡,导致肿瘤坏死。在缺氧条件下,磷酸化的STAT3(p- STAT3)与PD-L1物理相互作用,并促进其核内转移,增强了Gasdermin C(GSDMC)基因的转录。GSDMC在TNFα处理下被Caspase-8特异性切割,产生一个GSDMC N-末端结构域,在细胞膜上形成孔洞并诱导焦亡。细胞核内的PD-L1、Caspase-8和GSDMC对巨噬细胞来源的TNFα诱导的体内肿瘤坏死是必需的。此外,GSDMC的高表达与较差的生存率相关。抗生素化疗药物在乳腺癌中诱导焦亡。这些发现确定了PD-L1的非免疫检查点功能,并提供了一个意想不到的概念,即GSDMC/Caspase-8介导的非典型焦亡途径在癌细胞中导致肿瘤坏死。
这篇文章除了细胞死亡方式转换这个比较有意思的现象外,还有一个有意思的点:经典明星蛋白的非经典作用,即PDL1发挥非免疫检查点的功能(通常我们说到PDL1就认为是免疫检查点),而且这种作用与其细胞核定位有关(PDL1的经典定位是细胞膜和分泌蛋白)。如果大家对这类蛋白和研究感兴趣,可以联系我们讨论。

下面我们具体看一下这项研究:
研究背景:肿瘤坏死因子α(TNFα)在肿瘤发展中的作用存在争议,既往研究主要集中于其诱导的凋亡和坏死性凋亡,而对于其在肿瘤坏死中的作用机制了解较少。PD-L1作为重要的免疫检查点分子,其在肿瘤免疫逃逸中的作用已被广泛研究,但PD-L1在细胞核中的潜在功能尚未明确。
研究解决的问题:本研究探讨了PD-L1在肿瘤细胞中的非免疫检查点功能,特别是其如何通过调控Gasdermin C(GSDMC)的表达,将TNFα诱导的凋亡转变为焦亡,进而促进肿瘤坏死。
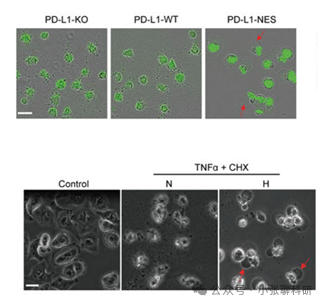
主要发现:
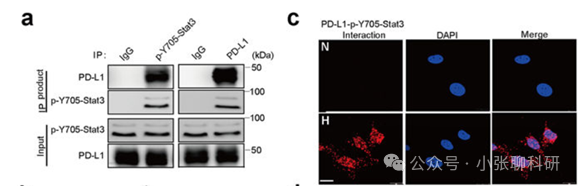
1. 在低氧条件下,磷酸化的Stat3(p-Stat3)与PD-L1物理相互作用,促进PD-L1的核内转移,增强GSDMC基因的转录。
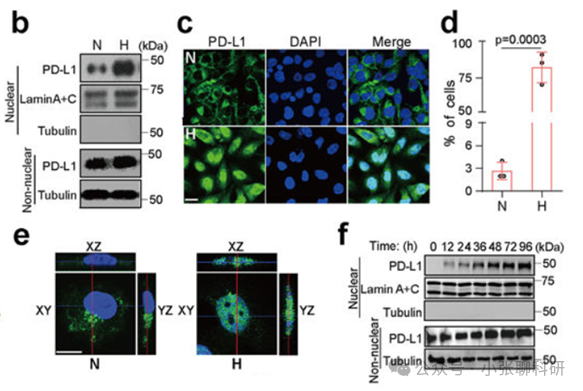
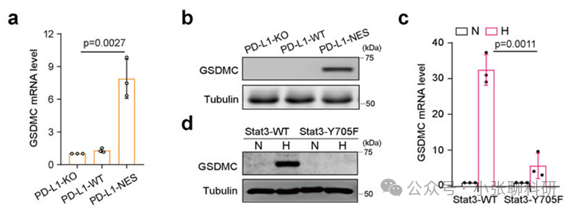
2. TNFα处理下,GSDMC被Caspase-8特异性切割,产生能够在线粒体膜上形成孔洞并诱导焦亡的N-末端结构域。
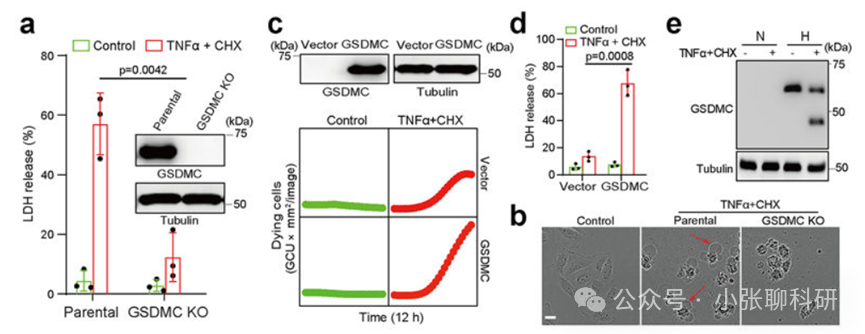
3. 核内PD-L1、Caspase-8和GSDMC对巨噬细胞衍生的TNFα诱导的肿瘤坏死至关重要。高GSDMC表达与较差的生存率相关联,某些化疗药物能够在乳腺癌中诱导焦亡。
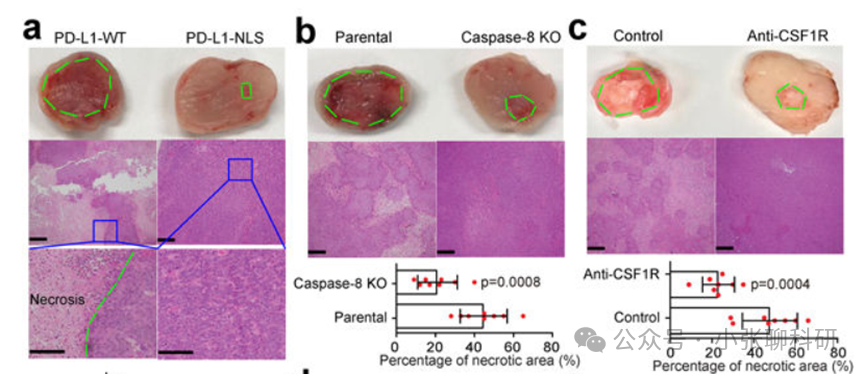
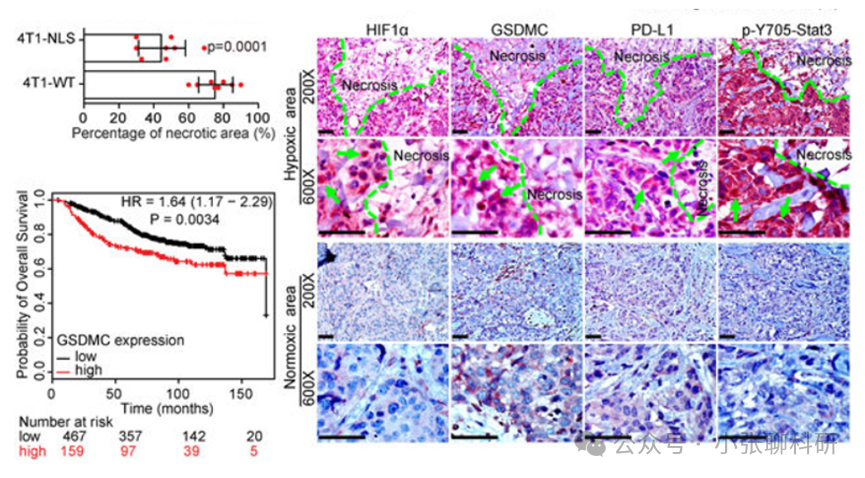
创新点:
1. 揭示了PD-L1在肿瘤细胞中的新功能,即通过调控GSDMC表达参与焦亡途径,而非仅作为免疫检查点。
2. 阐明了在低氧条件下,p-STAT3如何促进PD-L1的核内转移,并增强GSDMC的表达。
3. 确定了GSDMC/Caspase-8介导的非典型焦亡途径在癌细胞中的作用,为肿瘤治疗提供了新的视角。
2.
Electrostatic Charge-Mediated Apoptotic Vesicle Biodistribution Attenuates
Sepsis by Switching Neutrophil NETosis to Apoptosis.Small. 2022 May;18(20):e2200306.
静电电荷介导的凋亡小体生物分布改变,通过将中性粒细胞的NETosis转变为凋亡,以减轻脓毒症。

间充质干细胞(MSC)治疗能够减轻脓毒症中的器官损伤并降低死亡率;然而,其详细机制尚未完全阐明。本研究发现来源于间充质干细胞的凋亡小体(apoVs)能够改善脓毒症小鼠的多器官功能障碍并提高其生存率。机制上,研究发现通过尾静脉注入的apoVs主要通过与带正电荷的中性粒细胞胞外陷阱(NETs)的静电电荷相互作用,在脓毒症小鼠的骨髓中积累。此外,apoVs通过apoV-Fas配体(FasL)激活Fas途径,促使中性粒细胞的NETosis转变为凋亡。总结来说,这些发现揭示了apoVs在脓毒症治疗中先前未知的作用以及静电电荷导向的靶向治疗机制,表明细胞死亡与疾病的发展和治疗有关。
第二篇文章我们就不展开了,感兴趣的可以自行查看原文。
