

AMPK(adenosine monophosphate activatedprotein kinase),即单磷酸腺苷活化蛋白激酶,发现于20世纪70年代,1987年由Carling等[1]命名。近几年来,AMPK的结构与功能得到了深入和广泛的研究。生理状态下,AMPK被单磷酸腺苷(AMP)激活后,通过其催化亚基磷酸化下游的一系列酶类底物,增强机体的分解代谢,同时减少合成代谢。AMPK参与肥胖、脂代谢异常、糖尿病、肿瘤、炎症以及阿尔茨海默病等疾病的发生与发展[2]。近年来研究发现,AMPK是高脂血症和2型糖尿病治疗药物的优良靶点[3],有多个AMPK激活剂候选化合物处于临床前及临床研究阶段。
1 AMPK结构与功能
AMPK是由1个催化亚基α(α1或α2)与2个调节亚基β(β1或β2)和γ(γ1、γ2或γ3)构成的异源三聚体蛋白激酶。理论上AMPK具有12种亚型结构。各亚型在人体内的分布具有一定的组织和器官特异性,其中α1、β1、γ1亚型的分布具有普遍性,而含有α2和γ3的亚型分别主要分布在心脏和骨骼肌中[4]。
AMPK各亚基中的结构域排布及空间结构如图1所示。α亚基主要由含有磷酸化位点Thr-172(174)的激酶域(kinase domain,KD)、自抑制域(auto-inhibitory domain,AID)和C-端的β-结合域(β-BD)构成。β亚
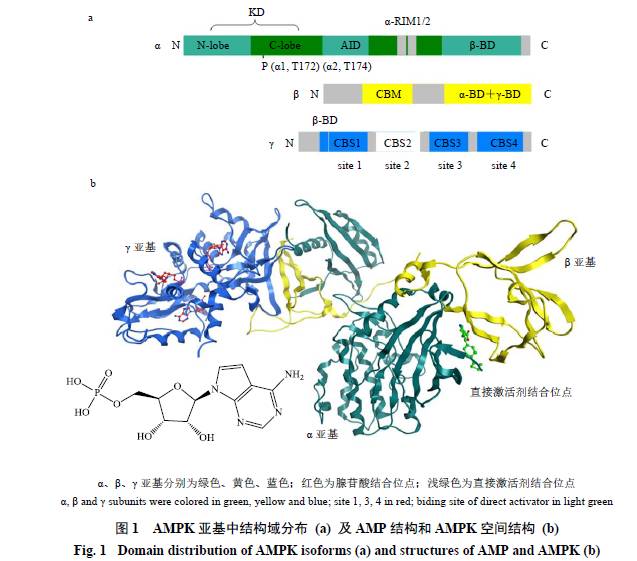
基主要由碳水化合物结合模块(carbohydrate-binding module,CBM)和位于C-端的α-、γ-BD构成,其作用是将其余2个亚基锚定在β亚基上,对保持激酶整体构象具有重要意义。γ亚基的3个亚型在N-端有较大的差异,依次为β-BD和2个Bateman域,后者中包含了4个腺苷酸结合位点(site 1~4)。
AMPK的上游通路主要包括肝激酶B1(liver kinase B1,LKB1)[5]、钙离子/钙调素依赖的蛋白激酶激酶β(calcium calmodulin kinase kinase β,CaMKKβ)[6]、转化生长因子-β激活激酶1(transforming growth factor β-activated kinase 1,TAK1)[7]。ATP生成减少或者能量过度消耗的时候,AMP/ATP值上升,主要由LKB1介导AMPK激活[8]。此3种激酶通过使α亚基的Thr172(174)磷酸化而激活AMPK,而体内的蛋白磷酸酶2C(protein phosphotases 2C,PP2C)可以催化去磷酸化而使AMPK失活。
AMPK下游的磷酸化靶蛋白多种多样。AMPK通过磷酸化抑制乙酰辅酶A羧化酶1(acetyl-CoA carboxylase 1,ACC1)、羟甲基戊二酰辅酶A还原酶(hydroxy methylglutaryl coenzymeA reductase,HMGR)[9]和固醇调节元件结合蛋白1c(sterol regulatoryelement-bindingprotein 1c,SREBP1c)[10]抑制脂肪酸和胆固醇的初始合成,并通过磷酸化抑制乙酰辅酶A羧化酶2(acetyl-CoA carboxylase 2,ACC2)加快脂肪酸在线粒体的氧化分解[11]。AMPK激活后通过肌细胞增强因子2(myocyte enhancer factor 2,MEF2)等诱导葡萄糖转运蛋白4(glucosetransporter type 4,GLUT4)向细胞膜的转位与表达,加速骨骼肌对葡萄糖的摄取[12]。AMPK激活后间接抑制哺乳动物雷帕霉素靶蛋白复合物1(mammaliantarget of rapamycin complex-1,mTORC1),以及影响翻译过程[13]进而影响蛋白的表达。总之,AMPK可以通过响应AMP/ATP值的变化被激活,从而磷酸化下游的蛋白分子,调节机体的生理和病理状态。
2 天然产物中的AMPK激活剂
天然产物来源于植物、动物、微生物的代谢物或者矿物质,具有独特的结构骨架,种类和数目繁多,理化性质各异。1981年至2014年底,已上市作为小分子药用的新化学实体中天然产物及其衍生物占总数的33%[14]。天然产物一直是新药发现的重要来源。目前,越来越多的天然产物被发现具有激活AMPK的作用。
从结构分类来看,天然产物中的AMPK激活剂可以分为生物碱类、酚类、黄酮类、萜类、糖苷类以及其他类。
2.1 生物碱类
小檗碱类生物碱是由2个异喹啉结构稠合而成。其中小檗碱(berberine,1)又称黄连素,来源于小檗科等40个科10个属的多种植物,具有抗菌、抗病毒、调血脂和降血糖的功效[15-16]。Turner等[17]证实,小檗碱及其衍生物二氢小檗碱(dihydroberberine,2)均可以剂量依赖性地抑制线粒体复合物I,从而激活AMPK,缓解高脂饲养C57Bl/6J小鼠肥胖,减少组织三酰甘油(TG)的积累,改善胰岛素抵抗。
紫堇碱(corydaline,3),即延胡索甲素,来源于罂粟科植物延胡索块茎,体外研究显示紫堇碱及其衍生物具有激活AMPK及抑制前蛋白转化酶枯草溶菌素(PCSK9)的活性,在治疗脂代谢异常方面具有潜在价值[18]。
血根碱(sanguinarine,4)属于苯啡啶类生物碱,来源于罂粟科植物白屈菜、紫堇以及博落回,具有抗菌和抗肿瘤的活性。Chio等[19]报道,血根碱可以直接激活含有α1γ1亚型的AMPK,分子对接的结果显示结合位点可能位于β-BD和γ-BD,但活性低于AMP [对α1β1γ1和α1β2γ1亚型的半数有效浓度(EC50)分别为AMP的4.7倍和14.0倍]。
辣椒素(capsaicin,5)是辣椒中辣味的来源,属于香草酰胺类生物碱,具有降低胆固醇和保护血管的功效。Kim等[20]报道,辣椒素在小鼠成肌C2C12细胞中诱导活性氧(ROS)的产生,间接激活AMPK和p38丝裂原活化蛋白激酶(p38 MAPK),从而非胰岛素依赖性地促进葡萄糖的摄取。
胡椒碱(piperine,6)是胡椒科植物如荜苃和胡椒中的一种桂皮酰胺类的生物碱,具有抗癫痫、抗氧化和免疫调节作用。Choi等[21]报道,胡椒碱可以激活高脂饲养小鼠肝脏中的脂联素-AMPK通路,从而加速脂肪酸氧化并改善胰岛素抵抗。
川芎嗪(ligustrazine,7)存在于伞形科植物川芎等中药中,是吡嗪类生物碱,具有抗血小板聚集、改善微循环等作用。Yi等[22]研究显示,高浓度的川芎嗪(4~8 mmol/L)在人胃癌SGC7901细胞中通过激活ROS从而激活AMPK,诱导Bax基因从细胞质向线粒体的转位,进而引发线粒体途径的细胞凋亡。
山羊豆碱(galegine,8)来源于豆科植物山羊豆的种子,是一种胍基生物碱,具有降血糖的作用。Mooney等[23]报道,山羊豆碱在大鼠肝癌H4IIE细胞、人胚肾HEK293细胞、脂肪3T3-L1细胞和大鼠成肌细胞L6中剂量依赖性地激活AMPK,浓度为500 μmol/L时可下调脂肪酸合成相关蛋白的基因表达,并可降低小鼠体质量。
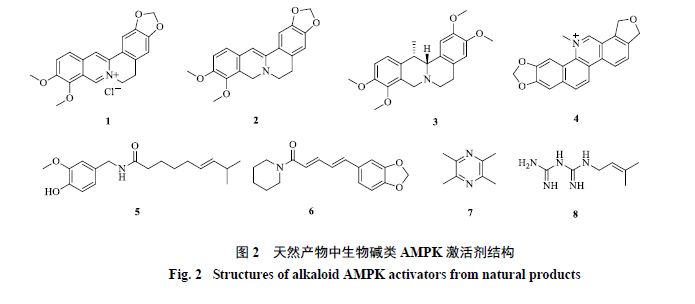
天然产物中生物碱类AMPK激活剂的结构见图2。
2.2 酚类
一些酚类化合物结构中含有多个酚羟基,一般具有抗氧化、抗病毒活性。
羟基酪醇(hydroxytyrosol,9)是来源于橄榄叶和橄榄油中的多酚类化合物。羟基酪醇在血管内皮细胞VECs中通过激活
AMPK而促进叉头转录因子3a(FOXO3a)向细胞核的转位,上调过氧化物酶体增殖物激活受体α/γ(PPARα/γ)和肉毒碱棕榈酰转移酶-1(CPT-1)基因表达,从而增强线粒体功能[24-25]。
白藜芦醇(resveratrol,10)又称为芪三酚,是一种来源于花生、葡萄和桑葚等植物果实的多酚类化合物。已有研究结果显示白藜芦醇在体外和体内均可以激活AMPK。Chen等[26]发现在3T3-L1细胞中,白藜芦醇通过激活AMPK降低了蛋白激酶B(PKB)的磷酸化水平,从而诱导线粒体途径的细胞凋亡。Zhang等[27]研究显示,白藜芦醇通过CaMKKβ/AMPK-mTOR通路介导肺癌A549细胞自噬性死亡,这一通路在Vingtdeux等[28]的研究中得到证实;并发现ig白藜芦醇可以激活小鼠脑内的AMPK,减少大脑皮质β淀粉样蛋白,具有治疗阿尔茨海默症的潜在价值。
姜黄素(curcumin,11)是存在于姜科和天南星科植物根茎中的一种含有β-二酮结构的多酚类化合物,具有多种生物活性。Soetikno等[29]研究显示,姜黄素通过激活AMPK-胆固醇调节元件结合蛋白(SREBP)通路,降低肾脏TG的积累,从而减少糖尿病肾病的发病率。Pan等[30]研究显示,在卵巢癌CaOV3细胞中姜黄素通过激活AMPK,促进LKB1、ACC、P38和P53的磷酸化,显示出细胞毒作用。去甲氧基姜黄素(DMC,12)是姜黄素的衍生物,研究显示在前列腺癌PC-3细胞中,DMC通过激活AMPK,下调热休克蛋白70与表皮生长因子受体(EGFR)表达,显示出细胞毒作用;另外,DMC激活可AMPK,抑制脂肪酸合酶(FAS)与ACC的表达[31]。
表没食子儿茶素没食子酸酯(epigallocatechin- 3-gallate,EGCG,13)是从茶多酚中分离出来的儿茶素类多酚化合物,是绿茶中的主要活性单体,具有抗氧化、抗菌、抗病毒、抗血栓、抗炎以及抗肿瘤等多种生物活性。研究发现EGCG通过抑制线粒体ATP合酶而抑制线粒体ATP合成[32],导致AMP/ATP值升高,从而间接激活AMPK。EGCG结构中含有多个酚羟基,在空气中的稳定性较差,而且口服生物利用度低,将其衍生化后有助于改善生物利用度和提高对AMPK的激活活性[33-34]。
大黄素(emodin,14)来源于蓼科植物虎杖和掌叶大黄的根茎,具有泄下、抗肿瘤、抗菌的功效,是一种蒽醌类多酚化合物。Song等[35]研究显示,大黄素在L6大鼠成肌细胞中通过激活AMPK诱导葡萄糖转运体4(GLUT4)向细胞膜转位,从而加快葡萄糖的摄取,并抑制参与糖异生途径基因的表达;同时发现,大黄素可以改善高脂饲养的C57Bl/6J小鼠的糖耐量和增强胰岛素敏感性。
没食子酸(gallic acid,15)来源于山茱萸科植物山茱萸的干燥果实,具有抗菌、抗病毒和抗肿瘤作用。Doan等[36]研究显示,没食子酸通过激活AMPK/Sirt1/PPARγ共激活因子-1α(PGC-1α)通路,改善饮食诱导肥胖小鼠的胰岛素敏感性和稳定血糖。
姜酚存在于姜的根茎中,有多种异构体,其中6-姜酚(6-gingerol,16)在骨肉瘤细胞中诱导caspase的激活并调节细胞凋亡相关的Bcl-2和Bax蛋白表达,诱导细胞凋亡,证明6-姜酚激活AMPK与细胞凋亡相关[37]。
水杨酸(salicylate,17)存在于柳树皮中,公元前2 000多年古埃及人就使用柳树叶子止痛,具有解热镇痛的功效,并可以抑制血小板的聚集,预防血栓形成。Hawley等[38]研究显示,水杨酸通过抑制Thr-172的去磷酸化,直接激活AMPK,其作用并不依赖于AMP/ATP值的变化,作用方式与直接激活剂A-769662相似;并可以增强肥胖小鼠胰岛素的敏感性。
Δ-9-四氢大麻酚(Δ-9-tetrahydrocannabinol,18)是大麻中的主要药理活性成分,具有麻醉和致幻的作用。Kola等[39]发现该化合物可以激活大鼠下丘脑和心脏中的AMPK,抑制肝脏和脂肪细胞中的AMPK,而对骨骼肌中的AMPK没有影响;综合3方面的作用,该化合物刺激动物食欲的同时减少了其能量消耗,因而可诱发脂质堆积。
meso-二氢愈创木酯酸(meso-dihydroguaiaretic acid,19)属于二苄基丁烷类木脂素,来源于美洲石炭酸灌木Larrea tridentate (DC.)Coville,具有抗氧化和抗病毒活性。Lee等[40]研究显示,该化合物通过激活AMPK信号通路,上调PGC-1α、PPARα、CPT-1等脂肪酸氧化相关基因,同时抑制SREBP-1c、ACC、FAS等脂肪合成相关基因的表达,从而控制脂质的合成。
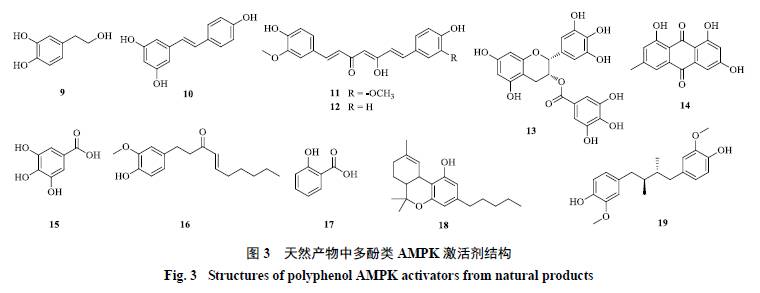
天然产物中酚类AMPK激活剂的结构见图3。
2.3 黄酮类
金雀异黄酮(genistein,20),即染料木黄酮,是一种存在于大豆和红三叶草等植物中的异黄酮化合物,具有诱导凋亡和抑制血管生成作用和雌激素样活性。Palacios-González等[41-42]报道,金雀异黄酮在成肌细胞C2C12中可以激活AMPK的磷酸化从而增加相关代谢酶的表达,加快骨骼肌中脂肪酸的氧化;并且发现该作用是通过JAK2介导的AMPK磷酸化激活产生的,是瘦素-受体非依赖性的过程。Lee等[43]研究显示,金雀异黄酮可以通过激活LKB1-AMPK-mTOR通路诱导血管平滑肌细胞发生自噬,这种作用呈时间和剂量依赖性。
高车前素(hispidulin,21)是从菊科植物毛莲蒿及天山雪莲中提取出来的一种黄酮类化合物,具有保肝、抗炎和抗氧化作用。Yang等[44]发现,高车前素在人卵巢癌SKOV3细胞中激活AMPK后,通过抑制mTOR,导致Mcl-1基因表达减少。因此,该研究结果为死亡受体结合AMPK激活剂治疗癌症提供了新的思路。
查耳酮主要分布在菊科、豆科和苦苣苔科等植物中,具有多种生物活性。甘草查耳酮A(licochalconeA,22)大量分布在豆科植物甘草的根茎中,具有抗菌和抗肿瘤活性;Quan等[45]研究显示,甘草查耳酮A通过影响肝癌HepG2细胞线粒体ATP生成,间接激活AMPK,进而抑制SREBP-1c和ACC1表达,并上调PPARα与脂肪酸转运体FAT/CD36表达,最终抑制TG在细胞中的聚集。这一结论在高脂饲养ICR小鼠为模型的实验中得到证实。Han等[46]研究显示,甘草查耳酮E(licochalcone E,23)通过激活AMPK/Sirt1通路,抑制SREBP-1c表达,进而抑制肝脏脂质生成。Zhang等[47]报道了4种查耳酮类化合物,分别为来源于水芹科植物明日叶的4-羟基德里辛(4-hydroxyderricin,24)和黄色当归醇(xanthoangelol,25),来源于胡椒科植物卡瓦的黄卡瓦胡椒素B(flavokawain B,26)和姜科植物草豆蔻的小豆蔻明(cardamonin,27)。研究显示,这4种化合物浓度为5 μmol/L时可以激活LKB1- AMPK通路,抑制下游SREBP-1表达,并激活PPARα,进而缓解HepG2细胞中的脂质沉积。
川陈皮素(nobiletin,28)来源于芸香科植物川橘、柑橘和酸橙的果皮、叶和茎当中,具有抗炎、抗病毒、镇痛的活性。柑橘的果汁中含有川陈皮素的衍生物甜橙黄酮(sinensetin,29)。Choi等[48]研究显示,在3T3-L1细胞中,川陈皮素明显抑制胞内脂肪的堆积,该活性与抑制PPARγ和激活AMPK有关。Kang等[49]发现,40 μmol/L的甜橙黄酮亦具有相似的作用,与提高AMPK与ACC磷酸化水平和降低SREBP-1c表达,增强脂肪酸氧化利用有关。
槲皮素(quercetin,30)是一种黄酮醇类化合物,多以芸香苷、槲皮苷与金丝桃苷的形式存在于多种植物的花、叶和果实中,具有止咳平喘、保护心血管的功效。Shen等[50]研究发现,5、10 μmol/L的槲皮素及其代谢产物3′-甲氧基槲皮素(3′-methyl-quercetin,31)可以激活AMPK和内皮型一氧化氮合酶(eNOS),缓解离体C57BL小鼠动脉血管对次氯酸诱导的血管内皮功能障碍。Chen等[51]研究发现,槲皮素通过激活AMPK抑制tau蛋白的磷酸化,改善高脂饲养小鼠的认知障碍,提示槲皮素激活AMPK可能是治疗AD患者的1个潜在策略。Ahn等[52]发现,槲皮素可上调AMPK及ACC的磷酸化水平,抑制3T3-L1细胞的分化增殖,从而抑制脂肪的生成作用。
Panduratin A(PA,32)来源于姜科植物凹唇姜的根茎,是一种具有抗氧化作用的查耳酮类化合物。Kim等[53]研究发现,在3T3-L1、HepG2和L6细胞中,PA可以增加AMPK和ACC磷酸化水平,改变AMPKα2亚基的细胞定位,并证明
AMPK激活是LKB1依赖性的。对高脂饲养诱导的C57BL/6J肥胖
小鼠每日给予50 mg/kg剂量的PA,可以减少动物的体质量增长,降低脂肪量,缓解脂肪肝和改善血脂状况。
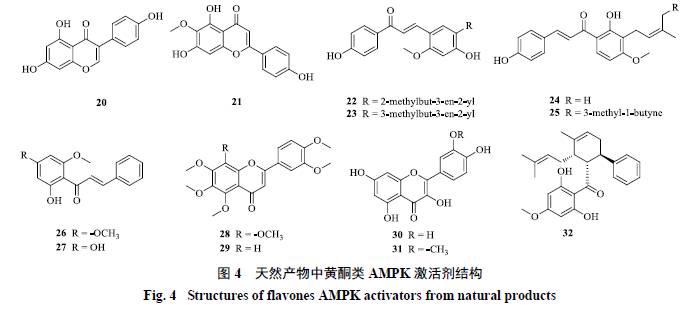
天然产物中黄酮类AMPK激活剂结构见图4。
2.4 萜类
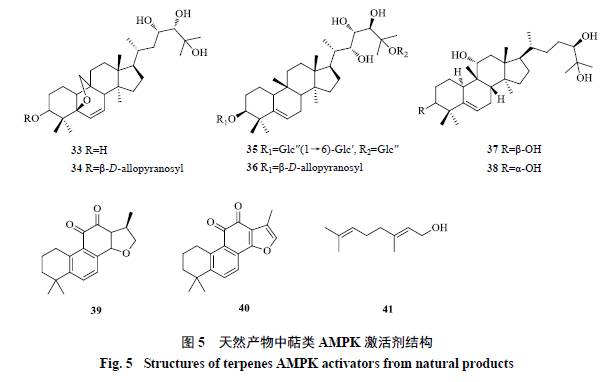
多种三萜化合物及其皂苷具有激活AMPK的活性。苦瓜是一种葫芦科植物,在温带和热带种植广泛,药食两用,具有清热解毒和降血糖的作用。
Tan等[54]从苦瓜中分离得到多个葫芦烷型三萜皂苷及苷元(33~36),这些化合物在L6和3T3-L1细胞中剂量依赖性地激活AMPK,2、10 μmol/L浓度AMPK激活剂5-aminoimidazole-4-carboxamide ribonucleotide(AICAR)活性相当,并且促进GLUT4从胞质向细胞膜的转位,从而增加葡萄糖的摄取。体内实验也显示部分化合物可以增加动物糖耐量,改善高脂饲养的肥胖小鼠的胰岛素抵抗并降低血糖;这些三萜类化合物激活AMPK需要LKB1的存在,与二甲双胍类似[55]。Chen等[56]从罗汉果中分离出2个罗汉果苷元(37、38),在HepG2细胞中显示出激动AMPK活性。
唇形科植物丹参中的一些萜类化合物具有激活AMPK的作用。其中,隐丹参酮(cryptotanshinone,39)是1种二萜类化合物,可以在不依赖ATP消耗的情况下激活AMPK。体外和体内实验表明它可以通过激活AMPK发挥减肥和抗糖尿病的作用。目前,该化合物由KT&G LifeSciences公司进行II期临床研究,适应症为肥胖、脂肪肝及肝硬化。丹参酮IIA(tanshinone IIA,40)可以激活人脐静脉内皮细胞HUVEC中的AMPK通路[57]。
香叶醇(geraniol,41)是来源于芸香科、百合科、唇形科等植物中的花香型香精,是1种无环单萜化合物。Kim等[58]研究显示,香叶醇可以同时抑制AKT并激活AMPK通路,两者共同作用导致mTOR被抑制,从而抑制PC-3细胞增殖。
天然产物中的萜类AMPK激活剂结构见图5。
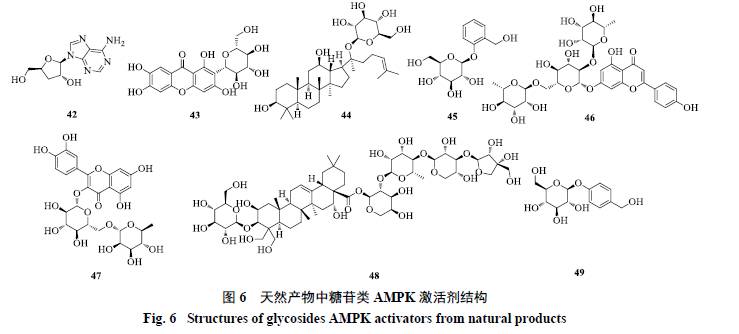
2.5 糖苷类
虫草素(cordycepin,42)即3′-脱氧腺苷,是冬虫夏草和蛹虫草的主要活性成分,也是第1个从真菌中分离出来的腺苷类化合物,具有抗肿瘤、抗衰老、抗菌、抗病毒、免疫调节、改善新陈代谢等功效。Wong等[59]研究发现,在小鼠胚胎成纤维细胞NIH3T3中,虫草素(50~200 μmol/L)可以通过激活AMPK抑制mTOR信号通路,进而抑制蛋白合成。Guo等[60]研究显示,虫草素可以降低高脂饲养的肥胖金黄地鼠血浆中总胆固醇和TG,提高肝脏和腹壁脂肪组织中AMPK和ACC的磷酸化水平。
芒果苷(mangiferin,43)主要来源于漆树科植物芒果的果实、叶、树皮,百合科植物知母的全株等,具有抗糖尿病、调节脂代谢异常、抗肿瘤和心血管保护等作用。Niu等[61]报道,芒果苷在HepG2细胞中可显著激活AMPK及促进下游蛋白磷酸化,促进脂肪酸的摄取及利用。同时发现,芒果苷可以剂量依赖性地降低Wistar大鼠血浆和肝脏中的脂肪酸及TG水平。
人参皂苷是来源于五加科植物人参根经中的1种三萜皂苷,具有类固醇活性。李伟[62]研究显示,1种罕见的人参皂苷compoundK(44)可以显著降低2型糖尿病ICR小鼠空腹血糖、改善胰岛素抵抗、提高胰岛素敏感指数、改善小鼠的葡萄糖耐量。Hwang等[63]亦发现compound K可以非LKB1依赖性地激活小鼠结肠癌CT-26细胞中的AMPK,该作用可能与增加细胞内Ca2+浓度有关。
水杨苷(salicin,45)通过水解释放出苷元水杨醇,经过氧化转化成水杨酸,可以直接激活AMPK。
女贞苷(ligustroflavone,46)来源于木犀科植物女贞,具有抗病毒和镇痛作用。郭文文等[64]报道,女贞苷在人肾上皮293T细胞中通过升高AMP/ATP值激活AMPK,进而促进脂联素高聚体的组装,具有潜在治疗2型糖尿病的价值。
芦丁(rutin,47)又称为芸香苷,是槲皮素与芸香二糖形成的糖苷,存在于芸香科、豆科、廖科等多种植物中,具有抗病毒和血管保护作用。Wu等[65]研究发现,芦丁通过激活AMPK下调SREBP-1的表达,抑制HMGR、FAS和ACC的活性,从而抑制肝细胞脂质堆积。
桔梗皂苷D(platycodin D,48)来源于桔梗科植物桔梗的根,具有宣肺、利咽等功效。Hwang等[66]报道,该化合物可以通过SIRT1/CaMKKβ通路提高高脂饲养大鼠和HepG2细胞中AMPK及ACC磷酸化水平,从而调节肝脏糖异生。
天麻素(gastrodin,49)来源于兰科植物天麻的干燥根块,具有镇静和安眠作用。耿雅娜等[67]研究显示,天麻素(169.3 μmol/L)可明显抑制油酸诱导的人肝HL-7702细胞中脂肪蓄积和TG的累积,并呈时间和浓度依赖性地增加细胞中AMPK和ACC磷酸化水平。
天然产物中的糖苷类AMPK激活剂结构见图6。
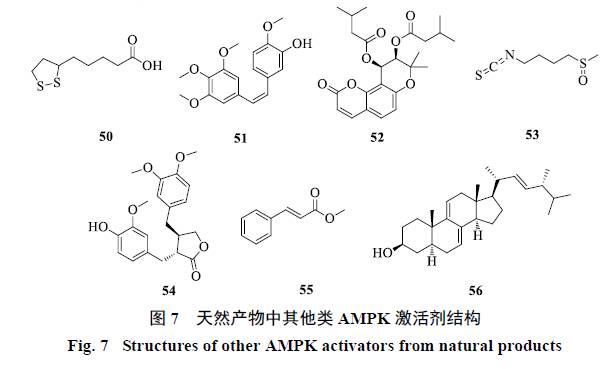
2.6 其他类
α-硫辛酸(alpha-lipoic acid,ALA,50)是广泛存在于动植物线粒体中的的1种辅酶。由于其具有非常强的抗氧化作用,可以用来改善老年痴呆和作为糖尿病神经性病变的辅助用药。对于胰岛细胞,ALA的慢性影响是通过激活AMPK使胰岛素分泌减少,急性影响可能涉及ROS诱导的线粒体功能受损,最终也导致胰岛素分泌减少[68]。Shen等[69]研究表明,在C2C12细胞中,ALA通过增加胞内Ca2+离子浓度,激活AMPK上游CaMKKβ从而激活AMPK。
Combretastatin A4(CA4,51)[70]是风车子属非洲灌木矮柳树树皮中分离得到的二苯乙烯类化合物,是1种微管蛋白抑制剂类抗肿瘤活化合物。Zhang等[71]研究显示,CA4通过降低ATP水平间接激活AMPK,下调糖异生相关酶的表达,并且激活ACC。
Choi等[72]从伞形科植物滨海前胡中发现了1种吡喃香豆素化合物cis-3′,4′-disovalerylkhellactone(cDIVK,52),该化合物浓度为30~50 μmol/L时可以激活3T3-L1细胞的AMPK,下调脂质生成的相关蛋白转录因子CCAAT增强子结合蛋白-α(C/EBPα)、PPARγ以及SREBP-1c,具有治疗肥胖和糖尿病的潜在价值。
萝卜硫素(sulforaphane,53)是一种异硫氰酸酯类化合物,存在于西兰花、芥蓝等十字花科植物中,具有强的抗氧化和抗癌活性。Choi等[73]研究显示,萝卜硫素通过激活AMPK和ACC,下调PPARγ、C/EBPα和瘦素在高脂诱导肥胖小鼠脂肪细胞中的表达并升高脂联素的表达,进而抑制脂质生成缓解肥胖。
牛蒡子苷元(arctigenin,54)来源于菊科草本植物牛蒡的干燥成熟果实,是牛蒡子中的苯丙素类活性成分,从结构上属于二苄基丁内酯类木脂素。Huang等[74]报道,L6细胞和离体骨骼肌中,牛蒡子苷元通过抑制呼吸链复合物I间接激活AMPK。实验表明单剂量ig牛蒡子苷元可以降低C57BL/6J小鼠的糖异生,长期ig牛蒡子苷元可以降低ob/ob小鼠的血糖和改善脂代谢。胰腺β细胞的内质网应激是导致胰岛素抵抗的重要因素之一。Gu等[75]研究显示,牛蒡子苷元通过抑制线粒体呼吸链复合物I而激活AMPK,从而抑制蛋白翻译过程,以缓解内质网应激,显现出治疗2型糖尿病的作用。同时发现,这种AMPK激活活性与上游激酶LKB1和CaMKKβ相关。Tang等[76]研究也发现,在大鼠心肌H9C2细胞和C2C12细胞中,牛蒡子苷元通过调节上游LKB1和CaMKKβ而激活AMPK。
肉桂酸甲酯(methyl cinnamate,55)来源于芸香科植物竹叶花椒,是1种天然的香味剂,具有抗菌和抑制酪氨酸激酶的活性。Chen等[77]研究显示,在3T3-L1细胞中肉桂酸甲酯通过激活CaMKK2-AMPK通路抑制SREBP-1、PPARγ和C/EBPα的表达,进而发挥抗脂质生成的作用。
Ergostatrien-3β-ol(EK100,56)是来源于苔芝属真菌樟芝的1种甾醇类化合物。Kuo等[78]报道,高脂饲养的C57BL/6J小鼠给予EK100后,可以改善其胰岛素抵抗的状态,这些功效与AMPK的磷酸化相关。
一些来自链霉菌属的抗生素如抗霉素A(antimycin A)[79]和寡霉素(oligomycin)[80]具有抑制线粒体ATP生成的作用,可通过AMP/ATP值的变化激活AMPK。
天然产物中其他类型的AMPK激活剂结构见图7。
3 结语与展望
AMPK激活剂按照作用位点的不同可分为直接激活剂和间接激活剂。直接激活剂直接作用于AMPK的亚基之上,变构激活AMPK。天然产物中的AMPK激活剂大部分属于间接激活剂,能通过以下其中1种或多种方式间接激活AMPK:(1)干扰线粒体呼吸链复合物生成ATP,提高细胞内AMP/ATP值;(2)激活AMPK上游激酶LKB1、CaMKKβ以及TAK1;(3)通过各种方式保持AMPK的磷酸化状态;(4)诱导ROS生成。与A-769662和991这些合成的直接激活剂相比,天然产物类的间接激活剂活性较弱,一般不会显现出对AMPK亚型的选择性。
许多天然产物结构独特,包含多个手性中心,合成难度大,来源有限,限制了化合物的进一步评价研究。以天然产物结构为先导物进行结构改造,选择适宜的合成方法予以化学合成,可以解决其来源问题,通过结构优化和活性筛选,可以改善其成药性。例如,通过对虫草素(42)进行结构优化,得到的化合物IMM-H007具有更高的活性与更好的成药性,体外实验和动物体内实验均显现出良好的临床开发价值[81]。将CA4(51)做成水溶性磷酸酯前药fosbretabulin二钠(CA4P),可以改善其理化性质,目前该化合物正处于II期临床研究,激活AMPK的同时具有抑制微管和调节PPAR的作用,其适应症为肿瘤[82]。
随着对AMPK蛋白结构与功能的研究逐渐深入,AMPK激活剂成为代谢调节药物研究的热点之一。源于天然产物的一些化合物或其结构优化产物已经进入临床研究阶段,如隐丹参酮和CA4P;也有一些处于临床前研究阶段,例如DC-250188、IMM-H007和BK-302[83]。
天然产物来源的AMPK激活剂在药物研究和开发中具有一定的潜在价值。随着天然产物研究尤其是海洋天然产物研究的快速发展,可以预见,越来越多的具有AMPK激活活性的天然产物将被发现,将为AMPK激活剂类药物的发现提供重要来源。
参考文献(略)
来 源:赵力挥,王 璐,刘文丽,王国成. 天然产物中的AMPK激活剂研究进展 [J]. 中草药, 2017, 48(18):3885-3896.

