今天这篇文章挺有意思,研究巨噬细胞的文章其实也不少,但这篇文章研究的点比较独特。这篇文章就是山东第一医科大学皮肤病医院博士生,发表在21.8分的Cell Mol Immunol上的文章。这篇文章分析了蛋白的糖基化,影响巨噬细胞内生细菌的课题。其实前期的验证还是有一些不够严谨的地方,但在最后通过一个WB的结果,假设迭代后,他们发现关键蛋白的糖基化与表型机制之间存在着联系,这就很有意思了(假设的迭代,就是通过已知的实验结果或者其他文献的佐证,在原有的假设基础上提出新的假设的过程,假设迭代也是推进一篇文章进展的关键,不清楚科研推理、假设或者假设迭代的话,可以去看看《科研的推理和逻辑:从实验台到咖啡桌》和《信号通路是什么鬼?》系列
)。我们就一起来看看他们都做了点什么吧:
他们研究的疾病是L-Lep(麻风瘤性麻风病),这个疾病是由于M. leprae(麻风分枝杆菌)感染后,进入巨噬细胞调节了免疫反应。他们之前的研究中,通过单细胞测序发现L-Lep中GPNMB的表达水平显著高于T-Lep(结核样麻风病,病灶较少),而L-Lep患者的抗菌先天免疫反应比T-Lep患者较弱。于是他们提出假设,假设GPNMB可能参与了巨噬细胞的抗菌先天免疫变化。在通过CRISPR敲除了GPNMB后,巨噬细胞体外感染M. leprae后发现,巨噬细胞细菌感染时促炎细胞因子的产生明显增强(这一部分验证,其实就是柯霍氏法则的验证,通过移除关键因素GPNMB,来分析对于巨噬细胞抗菌表型以及炎症因子生产表型的影响,不清楚柯霍氏法则的话,可以去看看《轻松的文献导读》和《科研的推理和逻辑:从实验台到咖啡桌》)。这就说明了GPNMB,可能参与了抑制了巨噬细胞遭遇细菌感染时促炎细胞因子的产生:
GPNMB是一种跨膜糖蛋白,而之前的研究表明,在小鼠巨噬细胞和麻风病患者皮肤病变中分离的巨噬细胞中,存在含麻风分枝杆菌的双膜空泡,这说明其间可能存在着异种自噬。于是他们提出了一个新的假设,假设GPNMB能影响巨噬细胞的自噬(假设的迭代就是建立在已有结果,和其他研究的证据之上的,通过假设的迭代可以进一步推进,这里他们考虑到了GPNMB是一种跨膜糖蛋白,而自噬又是一种膜结构相关的生物学过程,同时自噬形成的空泡与感染以及巨噬细胞有一定的关联,于是做出了这样的假设迭代,不清楚假设迭代的话,可以去看看《科研的推理和逻辑:从实验台到咖啡桌》和《信号通路是什么鬼?》系列):
通过对于自噬相关的蛋白p62以及LC3的验证,他们发现细菌感染后,GPNMB敲除的巨噬细胞中p62和LC3-II的水平均降低(p62和LC3-II都是常见的自噬相关的蛋白,LC3-II是结合在自噬膜上的蛋白,而p62则会结合泛素化蛋白将降解的物质包裹入自噬体内,自噬体和溶酶体结合后,p62则会被降解,不清楚自噬相关过程的话,可以去看看《信号通路是什么鬼?》系列的自噬相关几章复习下),也就是说GPNMB在细菌感染时破坏了异噬。使用EBSS促进自噬,导致了p62的降解,而在过表达GPNMB的细胞中p62的降解被消除,也就是说GPNMB阻断了自噬的通量。接着他们发现GPNMB对于自噬通量的影响,主要表现在了自噬体与溶酶体的结合被阻遏了。敲除了GPNMB后LC3单阳性的的囊泡变少,而LC3+LAMP+双阳性的囊泡增多,也就是说GPNMB阻断了自噬体和溶酶体的结合。
那GPNMB是如何影响自噬体和溶酶体的结合的呢?已知的情况是自噬体与溶酶体的融合,是由STX17-SNAP29-VAMP8或者YKT6-SNAP29-STX7这两种SNARE复合物的组装介导的,于是他们用coIP来分别分析了GPNMB与复合体上这些蛋白的互作,结果发现GPNMB可以与STX17结合。接着他们分析了者具体结合的结构域,他们发现STX17的TM结构域的去除,破坏了STX17和GPNMB之间的相互作用。而通过分析STX17-SNAP29-VAMP8复合体上STX17与SNAP29的结合关系,他们发现GPNMB会破坏STX17与SNAP29的相互作用(这一部分验证其实不太严谨,既然之前已经确认了GPNMB与STX17之间的结合,就应该分析两者的结合对于STX17-SNAP29-VAMP8复合体形成的影响,而不是去验证两者的表达对于STX17-SNAP29-VAMP8复合体形成的影响,这就会由于验证的命题中概念的外延不同,导致肯定后件的逻辑谬误,不清楚概念外延或者肯定后件逻辑谬误的话,可以去看看《科研的推理和逻辑:从实验台到咖啡桌》和《列文虎克读文献》系列):
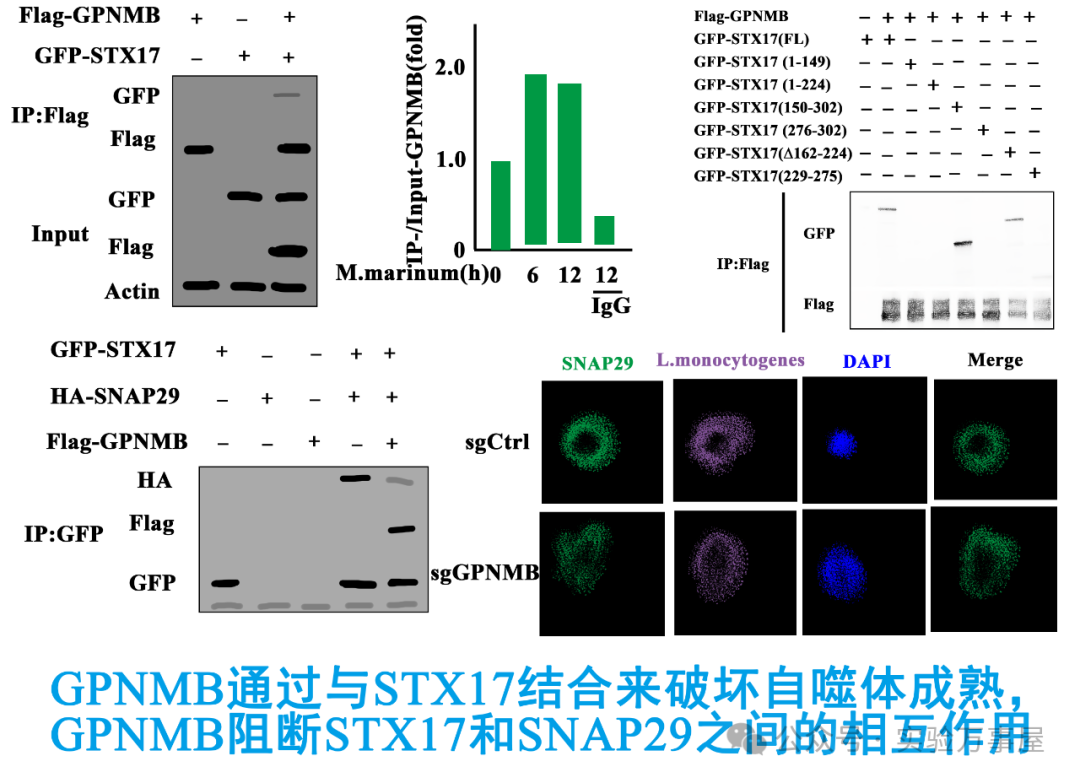
但在最后,出现了一个有意思的转折,由于之前验证coIP的时候,他们发现GPNMB与STX17之间的结合不但会影响STX17-SNAP29的结合,同时在Input中SNAP29的表达也受到了影响。结果他们发现GPNMB的表达,可以促进SNAP29的降解。由于GPNMB是一个高度糖基化的膜蛋白,于是他们假设是否GPNMB的糖基化会对SNAP29降解产生影响。他们通过筛选了GPNMB的12个糖基化位点的突变,来分析GPNMB的糖基化对于SNAP29降解可能造成的影响。结果发现GPNMB的N296Q的突变和N12Q的突变,可以促进SNAP29降解(这里通过对GPNMB糖基化位点的突变,来分析GPNMB去糖基化对于SNAP29蛋白讲降解的影响,也就是说概念的外延在这里得到了合理的缩小,当缩小外延之后,原有的可能存在逻辑谬误的点也都消失了,这样就做到了严谨性,接着他们还继续进行了突变对于自噬的影响,也就是扩大的表型的范围,这一部分的验证是值得认可的,不清楚概念外延或者肯定后件逻辑谬误的话,可以去看看《科研的推理和逻辑:从实验台到咖啡桌》、《列文虎克读文献》和《信号通路是什么鬼?》系列)。接着他们分析了GPNMB的N296Q的突变和N12Q的突变,对于自噬通量的影响,结果发现GPNMB的N296的去糖基化,可能会抑制异种自噬并促进感染过程中细菌的存活:
最后就形成了这样的示意图,M. leprae被内吞进入巨噬细胞后,形成了异体自噬的自噬体,通过自噬体和溶酶体膜上的STX17-SNAP29-VAMP8复合体形成,促进了自噬体和溶酶体的结合,促进了对细菌的降解。而GPNMB高表达后一方面糖基化降低,促进了SNAP29的蛋白降解,一方面GPNMB结合STX17,抑制了STX17-SNAP29-VAMP8复合体形成,导致溶酶体无法和自噬体结合,形成了空泡,并降低了巨噬细胞的促炎细胞因子的产生。GPNMB结合STX17,与GPNMB去糖基化后促进SNAP29降解,是两个独立事件:
这篇文章在最后的验证中通过突变,说明了具体的GPNMB去糖基化后促进SNAP29降解的机制,但是对于GPNMB结合STX17却还是有一定的逻辑漏洞的,如果这部分也通过STX17结合位点的突变来进行对后期自噬通量影响的验证,这篇文章会更好一些。好了,今天就先策到这里吧,有兴趣的话可以看看原文,祝你们心明眼亮。
(本文为夏老师个人观点,仅讨论文章本身,对超出文章以外的内容并不多做评价,如有异意,欢迎在评论区讨论)
喜欢夏老师讲文献的话,可以点点星标,点点赞,点点“在看”,多分享多转发。
目前夏老师已正式出版11本书,想要的可直接点以下微店小程序直接购买:
