蛋白酶体是细胞靶向性清除损伤和多余蛋白质的多亚基、超大型分子机器,据估计负责细胞内~80%蛋白质的降解【1】。它广泛参与蛋白质质量控制、细胞周期调控、免疫应答、应激反应等几乎所有生理过程。同时,其功能异常与多种疾病的发生密切相关,如神经退行性疾病、自身免疫病、癌症等【2】。尽管人们对蛋白酶体的工作原理有了一定的认识【3-5】,但对其调控机制的了解还非常有限。其中一个关键问题是,细胞是如何将几十个不同的亚基组装成有活性的蛋白酶体?
近日,武汉大学生命科学学院刘凯课题组与中国科学院生物与化学交叉研究中心张一小课题组合作在Science Advances杂志发表题为Molecular basis for the stepwise and faithful maturation of the 20S proteasome 的研究论文,揭示了20S蛋白酶体组装成熟的分子机制,表明它是一个环环相扣、受到精密程序调控的过程,为全面理解和操控蛋白酶体生成奠定了坚实基础。

为了解决20S蛋白酶体组装成熟中间体在细胞内含量低、易变化的挑战,研究团队通过表达突变体减缓了组装成熟进程,并通过特异性标记中间体实现了高效捕获。最终成功获得半蛋白酶体(half-proteasome)、全前蛋白酶体(preholoproteasome-1和 -2)等中间体,并采用冷冻电镜解析了它们的高分辨率三维结构。通过结构引导的功能性生化研究,深入回答了蛋白酶体组装成熟过程的三个关键问题:(1)如何保证蛋白酶体所有亚基有序安装到位?研究团队发现,组装伴侣蛋白介导前期亚基的依次安装;而最后一个被安装的亚基β7 具有“承前启后”的作用,它检测到关键亚基全部安装到位后才会插入复合体,宣告半蛋白酶体形成,转入成熟活化阶段。(2)催化位点的激活是如何实现的,又是如何在特定时间发生的?研究团队发现,两个半蛋白酶体二聚化的界面上具有三对关键回环,发挥“分子开关”的作用。它们感受对面半蛋白酶体的结合进而重塑催化口袋,分别启动三个催化位点的活化。(3)阻挡底物入口和占据催化反应腔的组装伴侣蛋白是如何定时清除的?研究团队发现,组装伴侣蛋白的清除时机受到严格调控,一方面避免早熟性清除导致的中间体坍塌;另一方面避免延迟清除造成的蛋白酶体失活。伴侣蛋白POMP占据催化腔,其清除时机受到催化亚基β2 和β5构成的“双重检测”系统的控制,只有当它们都活化之后才会降解POMP;伴侣蛋白PAC1/2阻挡底物入口,其释放由POMP的降解启动、由α5亚基作为“变构感受器和释放开关”来快速完成。至此,有活性的20S蛋白酶体形成。
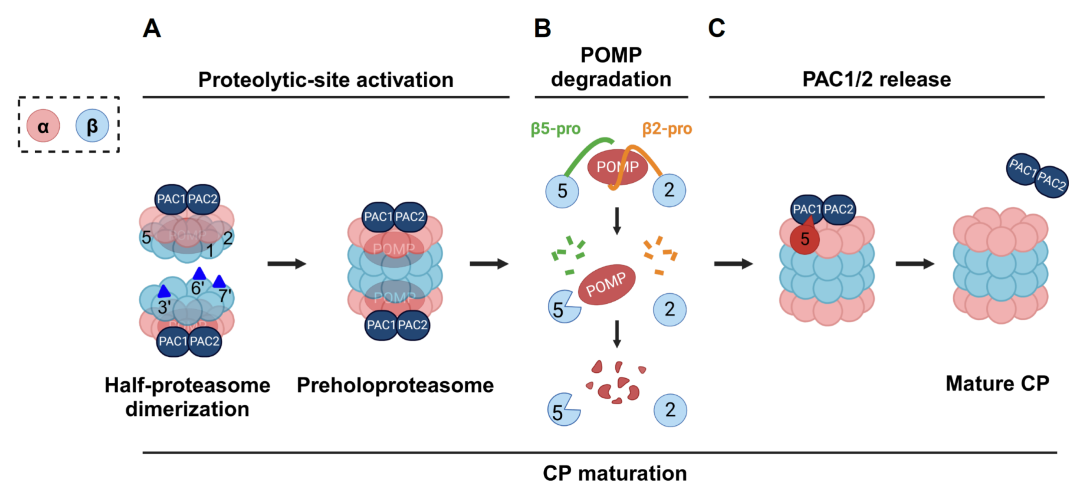
图:蛋白酶体组装成熟的分子机制。
总结起来,该工作建立了研究蛋白酶体组装机制与调控方式的新系统;描绘了蛋白酶体组装成熟的动态图景,揭示了介导其逐步、高保真发生的分子机制;为生成更多具有活性的蛋白酶体来抵抗蛋白质降解功能低下相关的健康挑战(例如衰老、神经退行性疾病等)提供了新思路。
中科院生物与化学交叉研究中心博士生韩瑶瑶、武汉大学生命科学学院硕士生韩芊和唐千千为论文的共同第一作者。武汉大学生命科学学院刘凯研究员和中科院生物与化学交叉研究中心张一小研究员为论文的通讯作者。
原文链接:http://doi.org/10.1126/sciadv.adr7943
制版人:十一
1. G. A. Collins, A. L. Goldberg, The Logic of the 26S Proteasome. Cell 169, 792-806 (2017).
2. A. Rousseau, A. Bertolotti, Regulation of proteasome assembly and activity in health and disease. Nat. Rev. Mol. Cell Biol. 19, 697-712 (2018).
3. X. L. Huang, B. Luan, J. P. Wu, Y. G. Shi, An atomic structure of the human 26S proteasome. Nat Struct Mol Biol 23, 778-785 (2016).
4. Y. Dong, S. Zhang, Z. Wu, X. Li, W. L. Wang, Y. Zhu, S. Stoilova-Mcphie, Y. Lu, D. Finley, Y. Mao, Cryo-EM structures and dynamics of substrate-engaged human 26S proteasome. Nature 565, 49-55 (2019).
5. A. H. De La Pena, E. A. Goodall, S. N. Gates, G. C. Lander, A. Martin, Substrate-engaged 26S proteasome structures reveal mechanisms for ATP-hydrolysis-driven translocation. Science 362, eaav0725 (2018).
BioART战略合作伙伴
(*排名不分先后)
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。



