儿童实体瘤占所有新诊断儿童癌症的三分之一,是儿童发病率和死亡率的主要原因。尽管已经对这些癌症的体细胞驱动因素进行了详细研究,但对导致肿瘤发生的最早风险因素的理解仍然不足。已知的易感基因仅能解释10%到15%的诊断。
由于这些癌症的发病年龄较早且肿瘤突变负担较低,种系遗传因素被认为在疾病发病机制中起重要作用。识别更多的种系风险因素可能有助于深入理解肿瘤发生的生物学机制,并为临床管理和治疗提供更明智的方法。
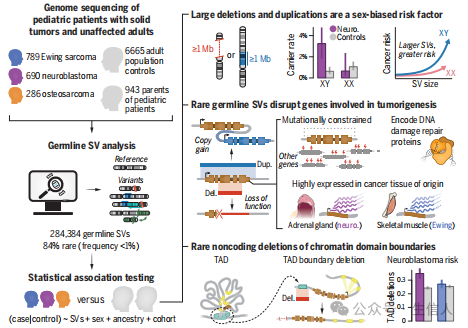
2025年1月发表在《science 》(IF:45.5)名为:“罕见种系结构变异会增加小儿实体瘤风险,Rare germline structural variants increase risk for pediatric solid tumors”的研究文章,这项研究介绍了罕见的种系结构变异(SVs)如何增加儿童实体瘤的风险。研究团队通过对1765名患有儿童实体瘤的患者、他们的943名未受影响的父母以及6665名成人对照组的种系基因组测序数据进行分析,揭示了罕见种系SVs在儿童实体瘤中的重要作用。
①SV的鉴定:每个基因组中位数为7275个种系SV。神经母细胞瘤和尤文肉瘤三联体中的新生种系SV率与一般人群相似(每基因组约0.2个),但新生SV显著更大且更可能是基因破坏性的。
 图1:展示了研究队列的结构和SV发现流程,包括样本来源、质量控制和SV注释
图1:展示了研究队列的结构和SV发现流程,包括样本来源、质量控制和SV注释
②性别偏倚的风险因素:发现超过100万个核苷酸的超罕见种系缺失或重复是儿童实体瘤的性别偏倚风险因素,男性患者相对于无癌对照的富集度是女性的四倍。
 图2:展示了大型罕见SV在儿童癌症患者中的富集情况,特别是男性患者中超过1 Mb的不平衡SV的富集
图2:展示了大型罕见SV在儿童癌症患者中的富集情况,特别是男性患者中超过1 Mb的不平衡SV的富集
③基因破坏性SV的富集:在神经母细胞瘤患者中,突变约束基因中的种系SV富集,影响DNA损伤修复基因的SV在尤文肉瘤和神经母细胞瘤中富集。这些SV倾向于破坏在癌症组织起源中高表达的基因,并在患者的肿瘤中表现为表达失调。
图3:展示了儿童癌症患者中基因破坏性SV的富集情况,特别是新生SV和超罕见SV
 图4:展示了超罕见SV对神经母细胞瘤和尤文肉瘤中关键途径和基因表达的影响
图4:展示了超罕见SV对神经母细胞瘤和尤文肉瘤中关键途径和基因表达的影响
 图5:展示了在已知癌症易感基因和COSMIC癌症基因中发现的基因破坏性种系SV
图5:展示了在已知癌症易感基因和COSMIC癌症基因中发现的基因破坏性种系SV
④非编码SV的富集:在神经母细胞瘤中,与成人对照相比,重叠染色质域边界的超罕见SV富集,而在尤文肉瘤中则没有这种富集,表明非编码SV可能在某些儿童实体瘤的发病机制中起作用。
 图6:展示了非编码种系SV在神经母细胞瘤中的富集情况,特别是重叠染色质域边界的SV
图6:展示了非编码种系SV在神经母细胞瘤中的富集情况,特别是重叠染色质域边界的SV
罕见种系SV的重要性:研究结果表明,跨越编码和非编码区域的罕见种系SV是儿童实体瘤的重要风险因素。在神经母细胞瘤中观察到的SV效应更强,这与神经母细胞瘤的发病年龄明显更早一致。估计罕见SV对这些癌症的遗传性贡献为1.1%到5.6%,这强调了罕见种系SV在儿童实体瘤的缺失遗传性中具有适度但有意义的作用。
临床应用:支持将种系SV分析整合到儿童实体瘤易感性的临床实践和研究工作中。
全面的SV分析:首次对儿童实体瘤的种系SV进行了全面分析,揭示了罕见SV在儿童实体瘤中的重要作用。
性别偏倚的风险因素:发现了超罕见SV在男性患者中的富集,为理解儿童癌症的性别偏倚提供了新的视角。
基因破坏性SV的富集:在神经母细胞瘤和尤文肉瘤中发现了基因破坏性SV的富集,这些SV倾向于破坏在癌症组织起源中高表达的基因。
非编码SV的富集:在神经母细胞瘤中发现了非编码SV的富集,这些SV可能通过影响染色质域边界来调节基因表达。
这些发现为儿童实体瘤的临床诊断和治疗提供了新的视角,特别是通过识别新的种系风险因素来改善早期筛查和个性化治疗,此外研究结果强调了进一步探索罕见种系SV在儿童癌症中的作用的重要性,特别是在非编码区域的SV。未来的研究可以集中在这些SV的功能验证和机制研究上,以开发新的治疗策略。